Dünnschichtchromatographie |
Unter Chromatographie versteht man
eine Reihe von Analysentechniken zum Trennen von Stoffgemischen. Allen chromatographischen
Techniken ist gemeinsam dass unterschiedliche chemische und physikalische Eigenschaften
die Laufzeit eines Stoffes durch ein Medium beinflussen. Durch die unterschiedlichen
Laufzeiten können die Stoffe dann unterschieden werden. Einige der heutzutage
empfindlichsten Analysentechniken wie HPLC,
>Gaschromatographie< und >Elektrophorese<
arbeiten nach diesem Verfahren.
Ein sehr einfaches Verfahren für erste
Versuche ist die >Papierchromatographie<. |
Wie schon der Name sagt findet der
Trennvorgang bei der Dünnschichtchromatographie, kurz DC, in einer dünnen
Schicht auf einem Trägermaterial statt. Im Gegensatz zum Verfahren mit Papier
sind die Schichten feinkörnig und sehr homogen sodass deutlich bessere und
reproduzierbare Chromatogramme erhalten werden können.
Diese Platten kann
man bei Firmen für chemischen Bedarf kaufen, sind aber nicht billig. Für
deutlich weniger Geld bekommt man die Platte bei Ebay.
Meist sind die Platten
ziemlich groß, 20x20cm oder auch 10x20cm. Ist das Trägermaterial Glas
lassen sie sich mit dem Glasschneider leicht in passende Stücke zerlegen. |
Entscheidend
für das Gelingen der Chromatographie ist die Wahl der agierenden Stoffe.
Als stationäre Phase werden meist Cellulose (Papier), Kieselgel oder
Aluminiumoxid, alles polare Stoffe vewendet. Die mobile Phase richtet sich nach
der zu testenden Substanz und wird nach der Polarität ausgewählt. Als
Grundstubstanz kann im Hobbybereich unpolares Leichtbenzin verwendet werden. Durch
Zugabe eines polaren Alkohols z.B. Isopropylalkohol kann dann die die Laufgeschwindigkeit
und der RF-Wert eingestellt werden.
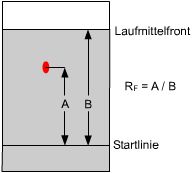
Der RF-Wert ist
wie im rechten Bild gezeigt das Verhältnis der Position des Substanzflecks
zur Laufmittelfront.
Ein Wert im Bereich von 0,5 bis 0,6 ist für eine
gute Auflösung anzustreben. Natürlich muß auch die Testsubstanz
in der mobilen Phase lösbar sein.
|  | | Faustregel:
ist der RF-Wert zu klein muss polares Mittel zugemischt werden, ist
er zu groß braucht die Mischung mehr unpolares Mittel |
|
| Nicht
ganz einfach ist das Aufbringen der Probe auf die Startlinie der Platte. Der Probenfleck
sollte klein sein und trotzdem möglichst viel Substanz enthalten. Besonders
dünnflüssige Proben verlaufen zu einem größeren Fleck wenn
zuviel Material auf einmal aufgetragen wird. So ist es besser kleine Mengen nacheinander
aufzutragen. Am besten geschieht das mit einer kleinen Pipette. Solche Mikroliterpipetten
kann man kaufen oder einfach selber herstellen indem man ein Glasrohr in der Flame
zu einer Spitze auszieht. |  |
|
| |  |  | |
mobile Phase: Wasser | mobile Phase:
Wasser / Ethanol 50:50 |
|
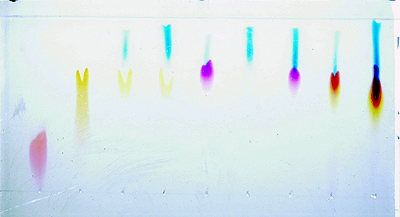
| Der
erste Test wurde wieder mit Filzschreibern aus geführt. Die Platte war mit
Cellulose beschichtet. Man sieht schon dass die Trennung für die einzelnen
Farben mit verschiedenen Laufmittel unterschiedlich ausfällt. So wird im
Fall von Wasser Blau und Magenta gut getrennt, in der Mischung nicht. Dafür
gelingt in der Mischung die Trennung von Rot und Blau besser.Das zeigt wie wichtig
es ist, dass das Laufmittel an die zu untersuchenden Stoffe angepasst ist. |
|
| Am
Besten bereitet man sich Gefäße mit verschiedenen Mischung vor. Zur
Aufbewahrung bewähren sich gut verschließbare kleinere Einmachgläser
in denen man auch gleich die Chromatogramme machen kann. Der Verfasser stellte
folgende Mischungen zusammen. |  | | | 1 | 2 | 3
| 4 | 5 | 6 | 7 | Benzin
| Benzin/ Isopropylalkohol | Benzin/Isopropylalkohol | Isopropylalkohol | Ethylalkohol
| Ethylalkol / Wasser | Wasser | 100 |
97:3 | 50:50 | 100 | 100
| 50:50 | 100 | <<<<<
weniger polar |
mehr polar >>>>> |
|
|
Sehr
interessant ist die Chromatographie von Naturfarbstoffen da diese meist aus mehreren
Komponenten bestehen. |
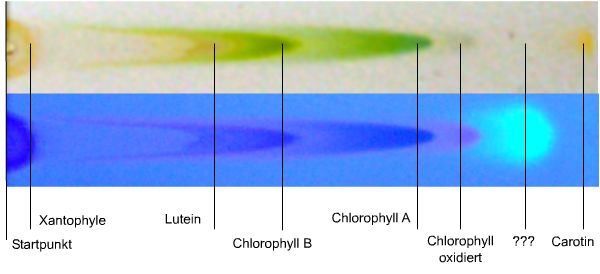 | Ein
erster Versuch mit Blattfarbstoff, hergestellt nach dem Rezept in
>Papier Chromatographie< war erfolgreich.
Die stationäre
Phase auf der Platte bestand aus Celloulose, die mobile Phase war einb Gemisch
aus Leichtbenzin und Isopropylalkohol 97:3.
Sechs Komponenten sind isolierbar
und eine siebte wird im UVA-Bild ( 365nm) erkennbar.
Neben der roten Fluoreszenz
des Chlorophylls ist eine Bande mit starker hellblauer Fluoreszens zu sehen. Die
konnte aber noch nicht zu geordnet werden. |
|
 | Die
Bedeutung einer Fluoreszenz-Aufnahme mit UV-Licht zeigt sich auch am Chromatogram
des Saftes der roten Bete.
Hier sind zwei Banden zu erkennen die im sichtbaren
Bereich nicht zu sehen sind. Das Chromatogramm wurde mit Benzin/Isopropylalkohol-
Mischung 100:3 aufgenommen. | Die Lage der beiden Banden
entspricht etwa der von Chlorophyll A und Chlorophy B. Auch hier ist wieder die
rätselhafte hellbaue Fluoreszenz zu sehen. Der auffällige rote Farbstoff
der roten Bete ist weitgehend am Startpunkt geblieben, was für polare Eigenschaften
spricht.
Um die roten Farbstoffe zu trennen muss deshalb ein anderes Laufmittel
gewählt werden. Mit einer Mischung von Ethanol und Wasser 50:50 als Laufmittel
können die zwei rote Farbstoffe getrennt werden. Am Startpunkt bleibt nichts
zurück. |  | noch
besser funktioniert die Trennung allerdings mit
>Elektrophorese< |
|
|
| |
|
|
|
|
| |
| |
| |
| |
| ; |

